Az ELKH Természettudományi Kutatóközpont (TTK) Biomolekuláris Kölcsönhatások Kutatócsoportja vezetésével, magyar, amerikai és olasz kutatócsoportokból álló nemzetközi konzorcium vizsgálta, hogy miként változtatja meg a gazdasejt osztódását szabályozó enzimek működését egy herpeszvírus-fehérje.
A Kaposi Mór által 1872-ben először leírt és róla elnevezett szarkómabetegségről a múlt század végén állapították meg, hogy kialakulása a herpeszvírus-fertőzéshez köthető. A herpeszvírusok olyan DNS-vírusok, amelyek már régóta az emberrel együtt fejlődnek, és egészséges emberekben ma már nem okoznak komoly betegségeket. A kutatók éppen ezért feltételezték, hogy az ilyen vírusok alaposan kitanulták a gazdaszervezet működését, így azt a nekik megfelelő módon tudják módosítani, ezáltal „megszelídült” formában modellként alkalmazhatók.
A nemzetközi konzorcium biokémiai módszerekkel és számítógépes szimulációk segítségével tanulmányozta a Kaposi-szarkóma herpeszvírus (KSHV) egyik fehérjéjének (ORF45) hatását az emberi sejtekre. Megállapították, hogy a KSHV ORF45 fehérje a sejtnövekedésben fontos jelátviteli pályák két meghatározó fehérjekinázát egyszerre köti, ezáltal a gazdasejten belüli természetes komplexek kialakulásának és szétválásának dinamikája megváltozik, ami aztán megnövekedett sejtnövekedési jelpálya-aktivitáshoz vezet. Mivel a kinázok olyan enzimek, amelyek más fehérjék működését foszforiláció – azaz egy gyakori kémiai fehérjemódosítási mechanizmus – révén változtatják meg, a vírusfehérje jelenlétében megnő a fehérjék egy csoportjának a foszforilációja.
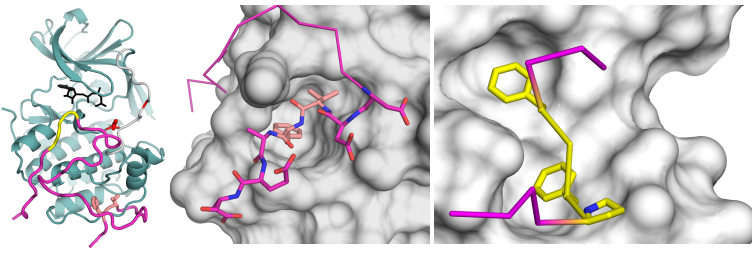
A kutatócsoport atomi felbontású felvételeket is készített a két enzim és az ezek kötésére szakosodott vírusfehérje-régiók által alkotott komplexekről. Az eredmények nemcsak arra adtak magyarázatot, hogy a vírusfehérje miképpen programozza át az emberi fehérjekomplexek működését, hanem a kutatók olyan ismeretlen fehérje-fehérje kölcsönhatásokat is feltártak, amelyek a gazdasejt megfelelő működéséhez is eleve szükségesek.
A herpeszvírus-fehérjék a molekuláris szintű zavarkeltés nagymesterei, ami a gazdasejtekben patológiás működéshez vezet.
A Kaposi-szarkóma herpeszvírus – hasonlóan más vírusokhoz – „kiismerte” a sejten belüli bonyolult szabályzórendszerek gyenge pontjait.
A konkrét mechanizmus molekuláris mimikrin, azaz utánzáson alapszik,
melynek során a vírusfehérje olyan fehérjefelszínekhez kötődik, amelyek a sejtnövekedés és sejthalál kényes egyensúlyának a beállításáért felelős enzimeken helyezkednek el.
A „szelíd vírusok” által alkalmazott biokémiai trükkök megismerése a humán sejtek növekedési zavarainak – például fokozott sejtosztódás, rák vagy fokozott sejthalál, gyulladás – visszaszorítására kínál újabb és újabb lehetőségeket. A kutatócsoport most olyan vegyületeket fejleszt, amelyek a sejtnövekedést manipuláló vírusfehérjék által is kedvelt fehérjékhez kötődnek.
A kutatás eredményeit bemutató tanulmány a Nature Communications folyóiratban jelent meg.
A kutatást az NKFIH „Élvonal” és a VEKOP-2.3.3-15-2016-00011 pályázat támogatta.